4.6 热力学第二定律的统计意义
热力学第二定律指出,一切与热现象有关的实际宏观过程都 NOTE 是不可逆的。而热现象是大量分子无规则运动的集体表现,为了 加深对热力学第二定律的理解,下面以气体自由膨胀为例,从微 观角度来认识热力学第二定律。
设一个容器被隔板分成体积相等的 A、B 两部分,其中 A 部分充满同种理想气体,而 B 部分为真空(图 4-18)。
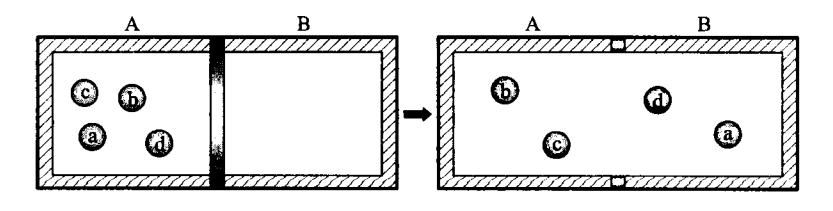
图 4-18 分子可能位置
首先考虑一个分子的情形。在隔板未打开时,这个分子只能位于容器中的 A 部分,若隔板打开,这个分子将在整个容器中运动,它位于 A 部分和 B 部分的机会相同,因此,它出现在 A 部分的概率为 1/2。若为两个分子,它们在 A、B 两部分的分配方式共有 种,每种方式出现的概率都相等,都等于 。若为 3 个分子,它们在 A、B 两部分的分配方式共有 种,每种方式出现的概率都等于 。若为 4 个分子,它们在 A、B 两部分的分配情况共有 种可能(见表 4-1),每种方式出现的概率都等于 。一般来讲,若系统由 N 个分子组成,则它们在 A、B 两部分的分配情况共有 种可能,且每种方式出现的概率都等于 。
| 分子的可能分配(微观态) | 不同宏观态包含的微观状态数 | |
|---|---|---|
| A | B | |
| abcd | 1 | |
| abc | d | 4 |
| abd | c | |
| acd | b | |
| bcd | a | |
| ab | cd | 6 |
| ad | cb | |
| ac | bd | |
| bc | ad | |
| bd | ac | |
| cd | ab | |
| a | bcd | 4 |
| b | acd | |
| c | abd | |
| d | abc | |
| abcd | 1 |
表 4-1 4个分子(分别为 a,b,c,d)在 A 和 B 中的分配情况
每一种可能的分配方式称为一种微观状态。从宏观上看,只要 A、B 两部分中的分子数各自不变,系统就具有相同的宏观属性,就表现为相同的宏观状态,根本无从区分究竟 A、B 两部分中到底是哪些分子,因而,将有多种可能的微观态与同一宏观状态相对应。例如由 4 个分子组成的系统,共有 16 种微观态,而宏观态只有 5 种(见表 4-1)。其中所有分子都在 A 部分的宏观状态只包含 1 种微观态。而 A、B 两部分中各有两个分子的均匀分配的宏观态包含的微观态最多。
因为每一种微观态出现的概率相等,所以包含微观状态数越多的宏观态出现的概率就越大。对于由 N 个分子组成的系统,例如系统为 1 mol,则 N 的数值为 6. ,所有分子都回到 A 部分的概率为 ,这种宏观态出现的可能性几乎不存在。
因此,从微观上看,气体之所以能自发地向真空膨胀而不能自动收缩,是因为所有分子都在 A 部分时所对应的微观态最少,因而出现的概率最小。而所有分子在整个容器内均匀分布时所包含的微观状态数最多,因而出现的概率最大。所以,气体的自由膨胀过程是由出现概率小的状态自发地向出现概率大的状态过渡,由包含微观状态数少(或混乱度小)的状态向包含微观状
态数多(或混乱度大)的状态过渡。其实,这是所有不可逆过程的共性。例如功转化为热过程,在功转化为热过程中机械能转化为内能。机械能是所有分子做定向运动的有序能量,而内能是分子无规则热运动的无序能量。很明显,所有分子都沿某确定方向运动的概率要比所有分子做无规则热运动的概率小得多,因此,功转化为热过程体现了通过分子间相互作用,有序运动极易变成无序运动,自然,宏观上必有功可以完全转化为热,而相反的过程发生的概率极小,实际上根本不可能发生。
所以,热力学第二定律的统计意义可概括为:一切实际的过程都是自发地由包含微观状态数目少的宏观状态向包含微观状态数目多的宏观状态进行,由出现概率小的宏观状态自发地向出现概率大的宏观状态进行。
从微观上看热力学第二定律的意义是什么?